APDSは(反復性の感染症を引き起こす)免疫不全と(自己免疫性合併症を引き起こす)免疫異常の両方を引き起こす原発性免疫不全症候群(PID)の一種です2,3。
原発性免疫不全症候群(primary immunodeficiency, PID)は、免疫系の発達や機能の不全を特徴とするさまざまな疾患の総称です。広義には、PIDは獲得免疫における障害と自然免疫における障害に分類されます。獲得免疫障害ではT細胞やB細胞が障害され、両方が障害されるものは「複合型免疫不全症(CID: combined immunodeficiency)と呼ばれます。自然免疫障害とは食細胞や補体系が障害されるものです。PIDでは多くの患者において易感染性の傾向がみられ、反復性の副鼻腔炎や中耳炎、肺炎など広範な臨床症状を呈します。また、発育不良、抗生物質の長期投与に対する治療抵抗性、持続する膣カンジダ症や皮膚膿瘍、複数の自己免疫疾患、PIDの家族歴などもPIDの特徴です1。
活性化PI3Kδ症候群(Activated PI3Kδ syndrome, APDS; 旧称PASLI) は末端臓器障害や早期の死亡をきたし得る進行性の原発性免疫不全および制御性の障害で、希少なタイプの複合型免疫不全症(CID)として2013年に認識されました2-7。日本では現在APDSに対して承認された治療法はなく、対症療法により管理されています。アメリカでは、2023年5月にPI3Kδ阻害薬がAPDSの治療薬としてFDAにより承認されました9。
APDSは(反復性の感染症を引き起こす)免疫不全と(自己免疫性合併症を引き起こす)免疫異常の両方を引き起こす原発性免疫不全症候群(PID)の一種です2,3。

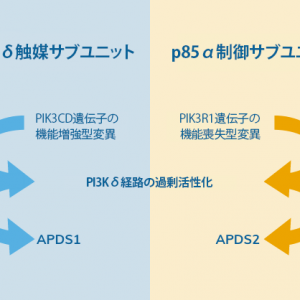
ホスファチジルイノシトール3-キナーゼ(PI3K)は様々な細胞表面レセプターによって活性化される脂質キナーゼ群に属し、細胞の代謝、成長、生存、分化、接着、移動に影響を及ぼす様々な下流標的分子を制御します1。APDSに関与する遺伝子として、リンパ球系細胞に特異的に発現するPIK3CD、PIK3R1の2つが特定されています2,3。PIK3CDまたはPIK3R1に特定の変異が起きると、触媒サブユニットであるp110δの機能増強(gain of function, GoF)、あるいは制御サブユニットであるp85αの機能喪失(loss of function, LoF)が起こり、結果としてPI3Kδシグナルが過剰に活性化し、APDSの臨床症状発現をきたします4,5。
触媒サブユニットであるp110δの機能増強型変異によるAPDSはAPDS1、制御サブユニットであるp85αの機能喪失型変異によるAPDSはAPDS2と分類され、いずれの場合もPI3Kδシグナル伝達経路が過剰活性化されます1,5-7。
PI3Kδシグナル伝達ネットワークは哺乳類の免疫細胞のシグナル伝達において基本的な役割を果たしており、獲得免疫と免疫寛容(自己免疫反応の回避)の両方が正しく機能するために必要です1-5。PI3Kの下流標的分子としてAKT、mTOR、FOXO1などがあり、T細胞やB細胞の細胞運命を決定する上で重要な役割を果たしています1。
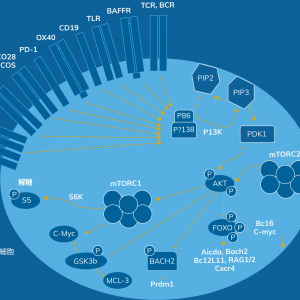
PI3Kδ経路のシグナルが適切に伝達されることは、B細胞およびT細胞の正常な発達、成長、認知機能、および正常な免疫機能に不可欠です6-10。健常人では、PI3Kシグナルの抑制によりFOXO経路が活性化することで免疫細胞増殖が促進される一方、PI3Kシグナルの活性化によりmTOR経路が活性化することで細胞分化が促進されるといったように、シグナル伝達のバランスが適切に調整されることによって、健康状態が保たれています。PI3Kδが過剰に活性化することでこの調整が妨げられ、FOXOが抑制されたりmTORの機能が亢進することによりB細胞やT細胞の発達異常をきたし、それが結果として成長や認知機能の発達に影響を及ぼします6,7,10-13。
APDSの症状は、PIK3CDまたはPIK3R1の特定の変異によりPI3Kδシグナルが過剰活性化することで惹起されます。
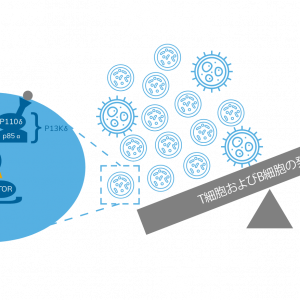
APDSの初期症状はさまざまであり、そのためCVIDやCIDと診断されることもしばしばあります。APDSで最も特徴的な症状は反復性の副鼻腔炎や肺炎であり、しばしばリンパ節腫脹を伴います。APDSの確定診断を行うためには遺伝子検査が必要です。
APDSでは、頻発する副鼻腔炎や肺炎、倦怠感などに関連した合併症、その治療のために必要な介入などによって、患者のQOLにとって大きな負担となります4,6 7-10。 患者は診断と治療の過程で複数の医師の診察を受けるため、多数の診療予約や紹介、入院、外科的介入、多剤併用療法などが患者の日常生活において大きな負担となることもあります1-7。